Tal como se describe en la Parte 1 de esta serie, los Dres. Michael Owens y Brooks Gentry, junto con sus colegas de la Universidad de Arkansas para Ciencias Médicas (UAMS, por sus siglas en inglés) y la compañía de biotecnología InterveXion Therapeutics (IXT), habían creado un anticuerpo monoclonal (mAb) destinado a ayudar a tratar la adicción a la metanfetamina al interactuar con esta y disminuir su capacidad de ingresar al cerebro. Ellos sometieron a prueba con éxito el anticuerpo, llamado IXT-m200, tanto in vitro como en animales. Los hallazgos convencieron a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) a que aprobara el estudio del IXT-m200 en seres humanos en 2013.
Fase 1: Una buena tolerancia del IXT‑m200 en los seres humanos
Al igual que todos los posibles medicamentos nuevos, para lograr su aprobación es necesario que el IXT-m200 pase por tres etapas de pruebas en seres humanos. Un ensayo de fase 1 explora por primera vez los posibles efectos adversos del nuevo medicamento prospectivo en los seres humanos. El ensayo también suministra información preliminar sobre la farmacocinética: cómo el cuerpo absorbe el medicamento, en qué parte del cuerpo se distribuye y qué tan rápido se degrada y excreta.
Para su estudio de fase 1, el equipo del IXT reclutó a 42 voluntarios sanos que no usaban metanfetamina. Cada voluntario recibió una sola inyección del IXT-m200 y las dosis individuales aumentaron de forma sucesiva. Luego, los investigadores observaron a los participantes durante más de cinco meses, un período suficiente para evaluar cuánto tiempo el IXT‑m200 permanece en el cuerpo. Los resultados fueron alentadores. Ningún voluntario sufrió una reacción adversa grave al anticuerpo. Algunos voluntarios notificaron problemas leves, solo algunos de los cuales parecían estar relacionados con la administración del IXT‑m200, y todos se resolvieron por sí solos. Como se predijo a partir de los estudios en animales y de otros anticuerpos monoclonales en humanos, el IXT‑m200 permaneció en la sangre en lugar de dispersarse en los tejidos. Su vida media fue de aproximadamente 18 días, lo que significa que los pacientes podrían mantener niveles terapéuticos en sangre si se administran cada 3 a 4 semanas.
El Dr. Gentry explicó que el estudio demostró que el anticuerpo realmente se toleró bien y, farmacocinéticamente, el perfil de concentración en sangre con el tiempo fue muy similar al esperado. La FDA estuvo de acuerdo, pero planteó una pregunta adicional: ¿Qué pasaría si los pacientes que eran adictos a la metanfetamina consumieran más de la droga en un intento por superar el efecto del IXT‑m200? ¿Podría esto causar alguna toxicidad inesperada? Los investigadores decidieron realizar estudios adicionales para responder a esta pregunta antes de proceder a las pruebas de fase 2, que se realizarían con personas que consumen metanfetamina.
El Dr. Gentry señaló que necesitaban hacer pruebas adicionales con altas dosis de metanfetamina en animales para demostrar que el anticuerpo no aumenta la toxicidad de esta droga. Afortunadamente, estos estudios no plantearon nuevas inquietudes y la FDA dio el visto bueno para el siguiente ensayo clínico.
Fase 2: ¿Redistribuirá el IXT‑m200 a la metanfetamina en el torrente sanguíneo?
Los ensayos clínicos de fase 2 prueban si un posible medicamento nuevo produce los efectos farmacológicos terapéuticos propuestos en el cuerpo humano que los científicos han observado en modelos con animales. También pueden servir como evidencia adicional sobre la seguridad que se recopiló en el ensayo de fase 1.
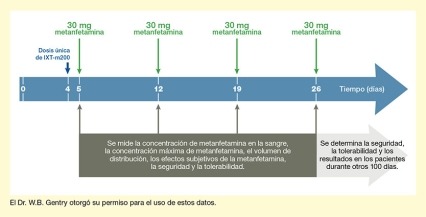
En su primer ensayo de fase 2 de los anticuerpos para terapia externa de metanfetamina, que el equipo denominó con las siglas STAMPOUT (por su nombre en inglés Study of Antibody for Methamphetamine Outpatient Therapy), el Dr. Gentry y sus colegas están tratando de establecer qué tan eficiente es el IXT‑m200 en captar la metanfetamina en la sangre y evitar sus efectos placenteros. Los participantes del ensayo son personas que consumen metanfetamina, pero no buscan tratamiento. Cada participante recibe dosis semanales de metanfetamina por hasta 4 semanas. Entre la primera y la segunda dosis, el paciente recibe IXT‑m200 o un placebo (vea la Figura 1). Después de cada dosis, los investigadores toman muestras de sangre en serie para determinar qué cantidad de metanfetamina es detectable en la sangre y durante cuánto tiempo. También preguntan a los participantes cómo perciben los efectos del medicamento y siguen de cerca las reacciones adversas durante otros tres meses.
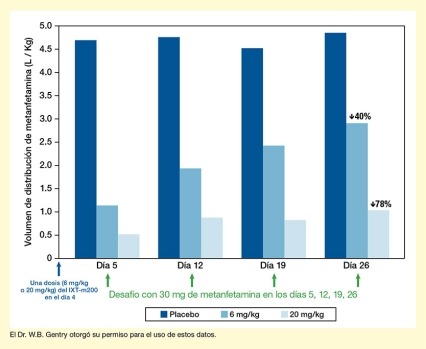
Recientemente, el equipo de IXT dio a conocer los resultados preliminares de los ensayos, utilizando datos de los primeros 36 pacientes que finalizaron el protocolo. Sus análisis indican que, entre esos pacientes, el IXT-m200 captó y retuvo de manera eficaz la metanfetamina en la sangre (vea la Figura 2). Con el transcurso del tiempo, las concentraciones máximas y la cantidad acumulada de la droga en la sangre fueron mayores con el IXT‑m200 que antes del tratamiento o con placebo. El Dr. Gentry está muy entusiasmado con estos hallazgos y afirma que estos datos provisionales constituyen la primera evidencia de que el IXT‑m200 altera la farmacocinética de la metanfetamina en los usuarios reales de esta droga.
El IXT-m200 sobrevive en la sangre el tiempo suficiente para que los pacientes solo necesiten dosis mensuales. Según explica el Dr. Gentry, esto es valioso, ya que no importa mucho si los pacientes omiten una dosis por unos días. La dosificación mensual requiere de menos tomas de decisiones diarias por parte de los pacientes.
Animados por los resultados preliminares que obtuvieron, el Dr. Owens y sus colegas continúan con el estudio STAMPOUT y esperan finalizarlo dentro de un año. Si los resultados con la totalidad de las cohortes del estudio confirman la promesa de los resultados preliminares y no surgen nuevos problemas, ellos consultarán con la FDA para el diseño de estudios adicionales.
Fase siguiente: ¿Ayudará el IXT-m200 a que se recuperen los pacientes?
Si los ensayos de fases 1 y 2 muestran que se tolera bien un posible medicamento nuevo y logra los efectos farmacológicos deseados, la pregunta continúa siendo: ¿Ayudará a los pacientes? Esa es la misma interrogante que plantean los ensayos posteriores. En el caso del IXT-m200, esto se traduce en: ¿Disminuirá la abstinencia y mejorará la calidad de vida de las personas adictas a la metanfetamina?
Si el IXT-m200 avanza a ensayos posteriores, esta es la primera vez que los pacientes reales que buscan abstinencia recibirán el mAb. A la fecha, los investigadores están proyectando un diseño de estudio básico en el que asignarán al azar a personas que consumen metanfetamina y están buscando tratamiento para que reciban un placebo o el IXT-m200 mensualmente durante un período de 6 meses. El Dr. Owens calcula que incluso si el equipo concluye el estudio STAMPOUT en 1 año, la finalización de los ensayos de las etapas posteriores demorará al menos hasta 2022 o 2023.
El Dr. Gentry añadió que, según su mejor cálculo al momento, están a unos 5 años de introducir el IXT-m200 en el mercado. Él explicó que todavía queda mucho que hacer para completar todos los pasos que la FDA requiere para la aprobación de un producto, y que están buscando formas de acelerar el programa y otros posibles mecanismos de apoyo para avanzar tan rápido como puedan.
La FDA ha señalado que hará lo que pueda para acelerar el proceso. La agencia ha reconocido que la adicción a la metanfetamina es una afección grave con una necesidad médica no satisfecha y, en consecuencia, ha asignado al IXT-m200 la prioridad de procedimiento acelerado "Fast-Track" en su estado de desarrollo.
No es una carrera corta, es una maratón
El IXT-m200 es el primer medicamento propuesto para la adicción a la metanfetamina que ha avanzado en el proceso de desarrollo hasta un ensayo de fase 2. (Para leer sobre otro proyecto de desarrollo de medicamentos apoyado por el NIDA para la adicción a la metanfetamina, consulte nuestra serie en inglés Narrative of Discovery, Parts 1 to 4). Aun así, el Dr. Owens y sus colegas esperaban haber avanzado más hasta el momento. El Dr. Owens admite que él pensaba que sería mucho más rápido y que varios miembros del equipo están un poco sorprendidos por el tiempo que se requiere para pasar por el proceso de desarrollo clínico.
Los investigadores afirman que el apoyo continuo del NIDA ha sido esencial y están agradecidos por el apoyo de infraestructura y de tipo no monetario que han recibido por parte de la UAMS a lo largo de los años. Sin embargo, el Dr. Owens señala que la única asistencia monetaria que ha recibido la empresa ha sido del NIDA.
El Dr. Gentry está de acuerdo en que el NIDA ha sido muy solidario y les ha ofrecido mecanismos de financiamiento que les ha permitido avanzar desde la investigación básica hasta los ensayos clínicos. Él explicó que este nivel de apoyo ha sido muy beneficioso para ellos y otros en esta rama que están intentando dar tratamiento y curar de los trastornos por el uso de sustancias.
Si bien les ha tomado muchos años llegar a este punto en el proceso de desarrollo de medicamentos, los investigadores señalaron que están contentos con la ruta que han tomado. El Dr. Gentry comentó que él deseaba asumir un proyecto que, de tener éxito, produciría un impacto en la salud humana y que lo han logrado.
El Dr. Owens añadió que son sumamente optimistas y que no hubieran hecho lo que han venido llevando a cabo durante tanto tiempo si no hubieran creído que iba a funcionar.
Este estudio contó con el apoyo de las subvenciones DA031944, DA028915, DA037593 y DA045366 de los NIH.
- Texto descriptivo de la figura 1
-
La figura ilustra el diseño básico de la fase 2 del ensayo STAMPOUT del mAb IXT-m200 contra la metanfetamina. La flecha horizontal azul indica el tiempo en días, con los días 0, 4, 5, 12, 19 y 26 marcados con líneas verticales blancas. Una flecha de color azul oscuro que apunta hacia abajo del día 4 indica que en ese día se administró una dosis única del IXT-m200 o un placebo. Las cuatro flechas verdes que apuntan hacia abajo en los días 5, 12, 19 y 26 indican la administración de 30 mg de metanfetamina en estos días. Las flechas de color gris oscuro que apuntan hacia arriba desde una casilla gris oscuro hacia los días 5, 12, 19 y 26 indican que en esos días se efectuaron análisis de la concentración de metanfetamina en la sangre, la concentración máxima de metanfetamina, el volumen de distribución, los efectos subjetivos de la metanfetamina, la seguridad y la tolerabilidad. Una flecha gris claro que apunta hacia la derecha debajo de la flecha azul indica que se continuó determinando la seguridad y la tolerabilidad del IXT-m200 y los resultados de los pacientes durante 100 días adicionales.
- Texto descriptivo de la figura 2
-
El gráfico de barras muestra la distribución de metanfetamina en el cuerpo como resultado del desafío con metanfetamina en diferentes días después del tratamiento con placebo o con dos dosis diferentes del mAb IXT-m200. El eje horizontal X representa diferentes puntos en el tiempo. Una sola flecha azul debajo del eje Y indica la administración de una dosis única de 6 mg/kg o de 20 mg/kg del IXT-m200, o bien de un placebo en el día 0. Los cuatro grupos de tres barras muestran los resultados para los días 5, 12, 19 y 26, respectivamente (de izquierda a derecha). Las barras de color azul oscuro indican los resultados después de la administración de placebo, las barras de color azul mediano indican los resultados después de la administración de 6 mg/kg del IXT-m200, y las barras de color azul claro indican los resultados después de la administración de 20 mg/kg del IXT-m200 en el día 0. Una flecha verde debajo cada grupo de barras indica un desafío con 30 mg de metanfetamina en esos días. El eje vertical Y muestra el volumen de distribución de la metanfetamina en L/kg en una escala de 0 a 5.0.
En el día 5, el volumen de distribución de la metanfetamina fue de aproximadamente 4.6 L/kg para los participantes que recibieron placebo, aproximadamente 1.1 L/kg para los que recibieron 6 mg/kg del IXT-m200 y aproximadamente 0.5 L/kg para los que recibieron 20 mg/kg del IXT-m200. En el día 12, el volumen de distribución fue de aproximadamente 4.7 L/kg para los participantes que recibieron placebo, aproximadamente 1.9 l/kg para los que recibieron 6 mg/kg del IXT-m200 y aproximadamente 0.8 l/kg para los que recibieron 20 mg/kg del IXT-m200. En el día 19, el volumen de distribución fue de aproximadamente 4.5 L/kg para los participantes que recibieron placebo, aproximadamente 2.5 L/kg para los que recibieron 6 mg/kg del IXT-m200 y aproximadamente 0.8 L/kg para los que recibieron 20 mg/kg del IXT‑m200. En el día 26, el volumen de distribución fue de aproximadamente 4.8 L/kg para los participantes que recibieron placebo, aproximadamente 2.9 L/kg para los que recibieron 6 mg/kg del IXT-m200 y aproximadamente 1.0 L/kg para los que recibieron 20 mg/kg del IXT- m200.
Fuente:
- Stevens, M.W., Tawney, R.L., West, C.M., et al. Preclinical characterization of an anti-methamphetamine monoclonal antibody for human use. mAbs 6(2):547-555, 2014.